BATTERI INTESTINALI ASSOCIATI ALLA SALUTE
- SANI E INFORMATI

- 8 ago 2023
- Tempo di lettura: 4 min
Nascimbe Andrea
Nei precedenti abbiamo dedicato un singolo Post per ognuna delle specie SIMBIOTICHE presenti nel nostro intestino, ovvero:
1-Faecalibacterium Prausnitzii
2-Roseburia intestinalis
3-Eubacterium hallii
4-Akkermansia muciniphila
Tutti e quattro Generi metabolizzano carboidrati semplici e Fibre alimentari per produrre grandi quantità di composti carbossilici come gli Acidi grassi a corta catena (SCFA), modulare la barriera epiteliale intestinale verso una maggiore selettività e stimolare la funzione immunitaria con un fenotipo tollerogenico (ovvero minore infiammazione)
.
Volutamente non abbiamo trattato, in questa nostra breve saga, i Generi Bifidobatterio e Lactobacillus, poichè già ben noti al grande pubblico. Sicuramente torneremo sull'argomento per fornire ulteriori specifiche sulle specie appartenenti a questi 2 generi.
Il microbiota simbiotico e le sue funzioni: alcuni cenni
E' noto che uno stile di vita eccessivamente igienico, il consumo di alimenti trasformati, poveri di fibre e l'uso frequente di antibiotici sono i principali fattori che possono portare a una disbiosi di lunga data. Il microbiota disbiotico è caratterizzato da composizione alterata, ridotta Biodiversità e livelli aumentati di batteri proinfiammatori contenenti lipopolisaccaridi
Il microbiota gastrointestinale umano è un ecosistema complesso costituito principalmente da batteri, ma anche virus e organismi eucarioti.
In totale, ad oggi nelle feci umane sono state trovate oltre 3000 specie batteriche mediante sequenziamento (Rajilic-Stojanovic, M.; de Vos, W.M. The first 1000 cultured species of the human gastrointestinal microbiota. FEMS Microbiol. Rev. 2014)
La maggior parte degli individui possiede circa 200 specie diverse nel proprio tratto digestivo con un'abbondanza molto variabile e una combinazione che rende la composizione del microbiota molto personale. Di questa popolazione batterica circa il 30% viene condiviso tra i soggetti, creando il cosiddetto microbiota di base comune (Faith, J.J.; Guruge, J.L.; Charbonneau, M.; Subramanian, S.; Seedorf, H.; Goodman, A.L.; Clemente, J.C.; Knight, R.; Heath, A.C.; Leibel, R.L.; et al. The long-term stability of the human gut microbiota. Science 2013)
Il microbiota intestinale influisce sulla salute e sulla malattia nell'uomo in molti modi come per esempio il mantenimento della barriera intestinale, elemento essenziale per l'omeostasi e la funzionalità dell'intestino. La compromissione della funzione di barriera è associata a malattie sia intestinali che sistemiche. In una situazione equilibrata per quanto riguarda le proprietà pro e antinfiammatorie del microbiota, stimola il Sistema immunitario generando segnali regolatori per indurre tolleranza verso il microbiota commensale.
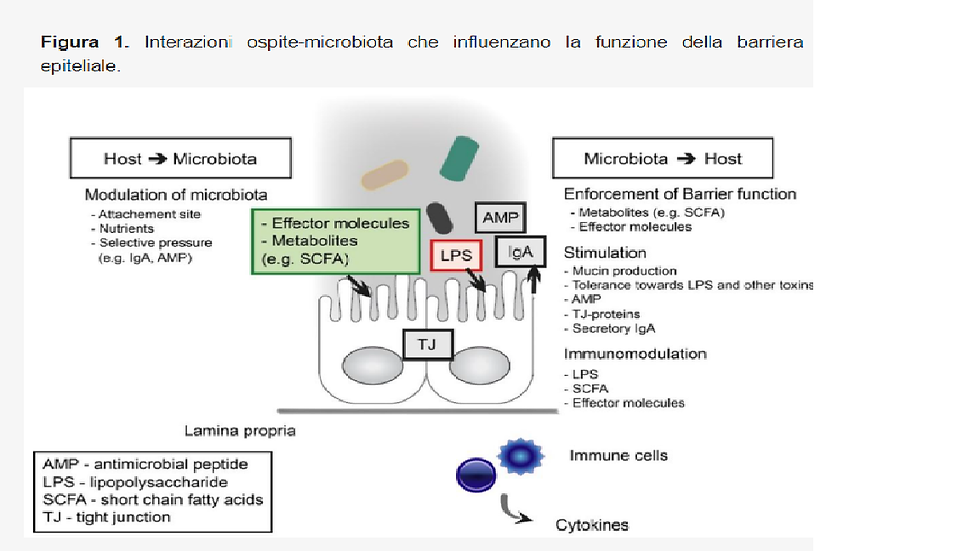
Il tratto digerente ha due distinti ecosistemi microbici, il microbiota luminale e quello della mucosa (Ouwerkerk, J.P.; de Vos, W.M.; Belzer, C. Glycobiome: Bacteria and mucus at the epithelial interface. Best Pract. Res. Clin. Gastroenterol. 2013)
Nel compartimento luminale, oltre il 90% dei batteri appartiene a Firmicutes e Bacteroidetes (i phyla minori includono Actinobacteria, Proteobacteria e Verrucomicrobia). Nello strato mucoso, il numero di batteri, così come la diversità, è notevolmente inferiore .
La composizione microbica è influenzata da una serie di fattori endogeni ed esogeni, come la fisiologia e l'immunità degli ospiti, la dieta e i farmaci. Nelle società contemporanee, uno stile di vita eccessivamente igienico con poche esposizioni ai microbi ambientali, il consumo di alimenti trasformati e poveri di fibre e l'uso frequente di antibiotici sono considerati i principali modulatori del microbiota umano e forti perturbazioni come queste possono portare a uno stato di disbiosi, e associarsi a numerose malattie ( Hertzen, L.; Beutler, B.; Bienenstock, J.; Blaser, M.; Cani, P.D.; Eriksson, J.; Farkkila, M.; Haahtela, T.; Hanski, I.; Jenmalm, M.C.; et al. Helsinki alert of biodiversity and health. Ann. Med. 2015)
La disbiosi del microbiota è generalmente caratterizzata da una composizione alterata, nonché da una ridotta diversità e stabilità (Walker, A.W.; Lawley, T.D. Therapeutic modulation of intestinal dysbiosis. Pharmacol. Res. 2013)
Nel complesso, un microbiota disbiotico non solo ha perso la capacità di supportare l'omeostasi intestinale, ma può anche esacerbare l'infiammazione.
Ad esempio, un aumento dei livelli di proteobatteri, avendo nelle strutture cellulari esterne i lipopolisaccaride (LPS), indurrà attivazione immunitaria.
Inoltre, la disbiosi del microbiota può compromettere la barriera epiteliale portando al cosiddetto intestino permeabile, consentendo al contenuto intestinale di entrare in contatto con la periferia dell'ospite, inducendo potenzialmente risposte infiammatorie, caratteristica immancabile delle malattie umane interagendo direttamente con gli enterociti dell'ospite e metabolizzando i carboidrati non digeriti in acidi grassi a catena corta
I batteri commensali metabolizzano le fibre alimentari e l'amido resistente in SFCA, come butirrato, acetato e propionato, fungendo da principale fonte di energia per gli enterociti ospiti.
Le fibre alimentari e gli SFCA hanno dimostrato in vivo di sopprimere l'infiammazione intestinale e il cancro del colon (Kim, M.; Friesen, L.; Park, J.; Kim, H.M.; Kim, C.H. Microbial metabolites, short-chain fatty acids, restrain tissue bacterial load, chronic inflammation, and associated cancer in the colon of mice. Eur. J. Immunol. 2018)
Il butirrato di origine microbica aumenta il consumo di ossigeno nei mitocondri negli enterociti e induce l'espressione di geni bersaglio dell'HIF che aumentano la funzione della barriera (Kelly, C.J.; Zheng, L.; Campbell, E.L.; Saeedi, B.; Scholz, C.C.; Bayless, A.J.; Wilson, K.E.; Glover, L.E.; Kominsky, D.J.; Magnuson, A.; et al. Crosstalk between Microbiota-Derived Short-Chain Fatty Acids and Intestinal Epithelial HIF Augments Tissue Barrier Function. Cell Host Microbe 2015)
D'altra parte, l'omeostasi intestinale viene mantenuta anche grazie all'interazione diretta del microbiota con dell'epitelio dell'ospite e con il sistema immunitario, dove il riconoscimento di molecole batteriche, come LPS, da parte dei recettori PRR dell'ospite (gli ospiti siamo noi) gioca un ruolo importante (Llewellyn, A.; Foey, A. Probiotic Modulation of Innate Cell Pathogen Sensing and Signaling Events. Nutrients 2017)
In conclusione, con questo sintetico articolo ho voluto solo darvi alcuni spunti di informazione generale che riguardano il nostro complesso ed affascinate micro-Universo intestinale, in altri Post tratteremo con dovizia di particolari molte delle funzioni che i nostri magnifici batteri sono in grado di svolgere in relazione alle malattie e/o diversamente alla Salute del nostro organismo.







Commenti